

乳腺癌(Breast Cancer)是全球女性中最常见的恶性肿瘤,其发生发展涉及遗传变异、微环境重塑及多种分子修饰的复杂交互作用。衰老作为乳腺癌最重要的风险因素之一,其在推动肿瘤起始和进展中的分子机制尚未完全明确。近年来,多种蛋白质翻译后修饰被证实与肿瘤的发生密切相关,其中由衰老所驱动的分泌蛋白表达变化,尤其是肝素结合生长因子Midkine(MDK)的异常表达,被认为在乳腺衰老微环境调控和肿瘤发生中起关键作用,但其具体功能机制和临床转化价值仍有待系统揭示。
Dana-Farber癌症研究所Kornelia Polyak教授团队在Cell子刊《Cancer Cell》上发表了一项重要研究。他们通过整合单细胞转录组(scRNA-seq)、染色质可及性测序(scATAC-seq)及功能性实验,首次在大鼠模型和人类样本中系统阐释了Midkine作为衰老驱动因子,通过激活 PI3K–AKT–mTOR–SREBF1 信号轴促进乳腺上皮衰老表型和肿瘤发生的机制。该研究不仅深化了对衰老微环境与肿瘤发生之间联系的理解,也为乳腺癌的早期风险预警和靶向预防策略提供了新的分子靶点与理论依据。
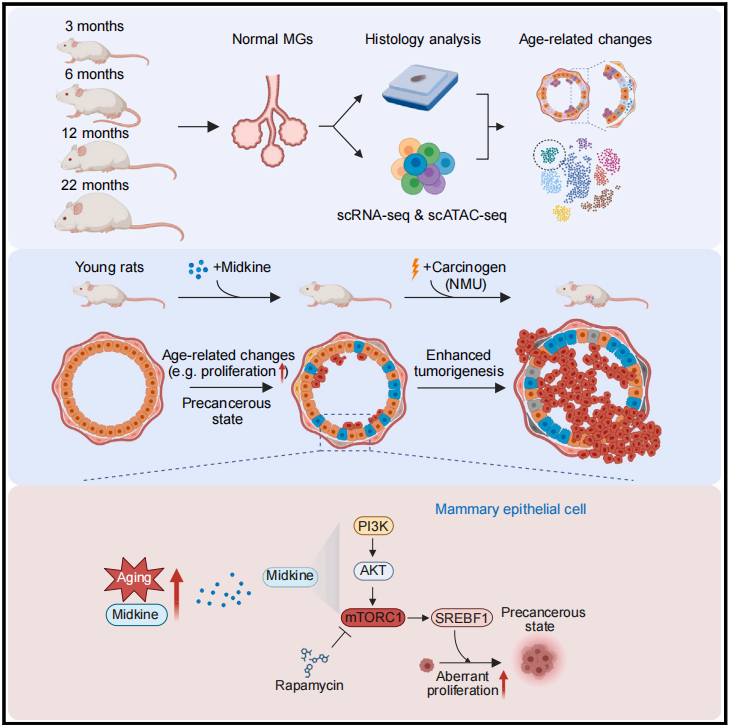
为系统解析衰老对乳腺微环境的影响,研究团队选取3月龄至22月龄大鼠乳腺组织,整合单细胞转录组(scRNA-seq)、染色质可及性(scATAC-seq)以及免疫荧光等多模态技术,构建了乳腺衰老的高分辨率分子图谱。
分析发现,随着年龄增长,乳腺上皮出现显著转录异质性升高和细胞身份模糊化,尤其表现为管腔上皮细胞中基底细胞标志物表达上升。研究人员鉴定出一类衰老特异性的管腔祖细胞亚群(Aging-LP),其转录特征提示前癌变状态。同时,伴随衰老的是初始B细胞与T细胞比例下降和单核来源巨噬细胞的扩增,提示免疫微环境向促癌状态倾斜。
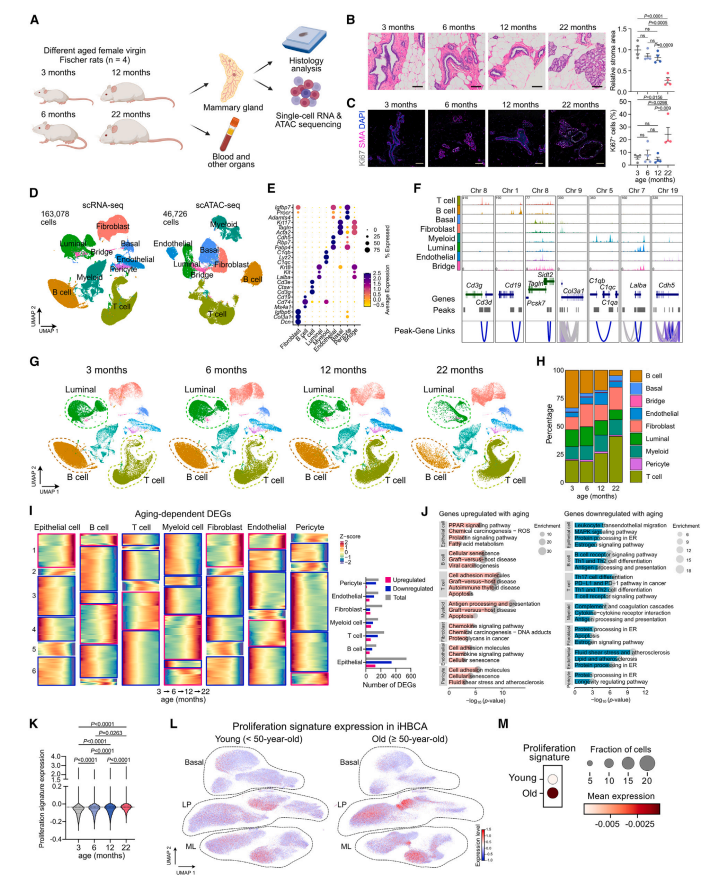
通过细胞间通信分析及配体-受体互作建模,研究团队发现肝素结合生长因子Midkine(MDK)在衰老乳腺组织中表达显著上调,尤其是在基底上皮细胞中。进一步利用重组Midkine处理年轻大鼠,可成功模拟衰老表型,包括上皮增殖增强、免疫细胞组成改变和Aging-LP群体出现。
为量化Midkine在衰老和癌变中的置信关联,研究整合大鼠与人类(如TCGA、METABRIC及iHBCA)多组学数据,证实MDK表达随年龄上升,且在BRCA2突变携带者和年轻乳腺癌患者中显著高表达,提示其作为年龄相关肿瘤驱动因子的普适性和临床重要性。
研究进一步借助SCENIC调控网络分析、染色质可及性及体外类器官模型,揭示Midkine通过激活 PI3K-AKT-mTOR 通路,促使转录因子SREBF1成熟并入核,调控脂代谢与增殖相关基因的表达。使用mTOR抑制剂雷帕霉素或SREBF1小分子抑制剂(Betulin、Fatostatin)处理,可有效逆转Midkine诱导的衰老表型和细胞增殖。
值得注意的是,研究人员还发现该通路可能存在正向反馈回路,抑制SREBF1同时下调MDK表达,强化了其在衰老微环境维持中的核心地位。
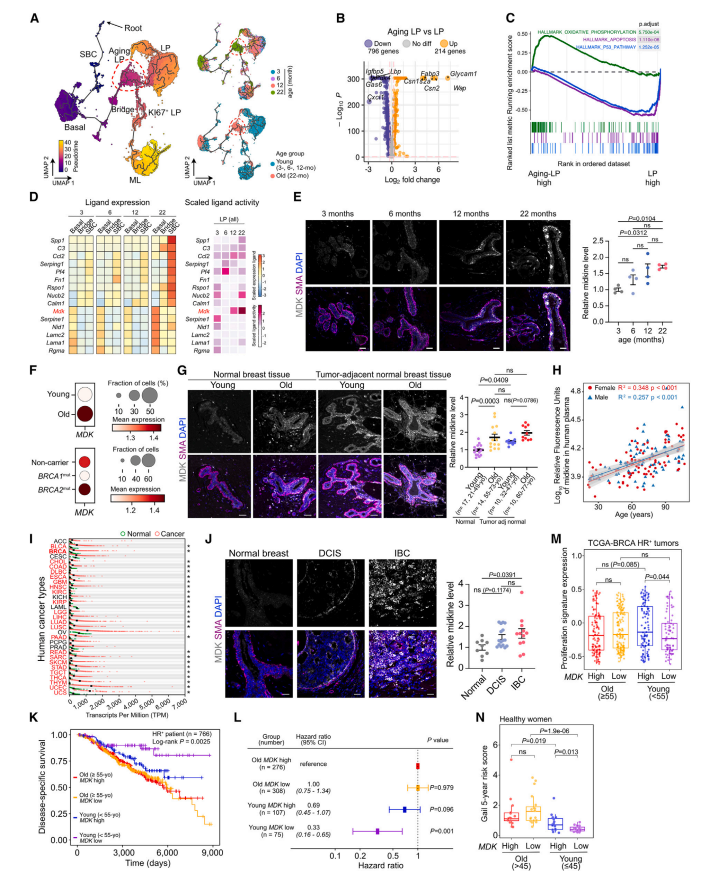
在研究团队构建的NMU诱导的大鼠乳腺肿瘤模型中,外源性Midkine处理显著提高肿瘤发生率、缩短潜伏期、增强肿瘤异质性,并伴随NK细胞和cDC1比例下降,提示免疫监视减弱。
临床队列分析显示,在年轻(<55岁)激素受体阳性乳腺癌患者中,肿瘤或正常组织中高MDK表达与不良预后显著相关。此外,基于MDK与衰老相关基因构建的 “MDK-age signature” 能更好区分高风险人群,且在Gail评分中显示与年轻人群乳腺癌风险显著正相关,凸显其作为年龄特异性液体活检和风险分层指标的潜力。
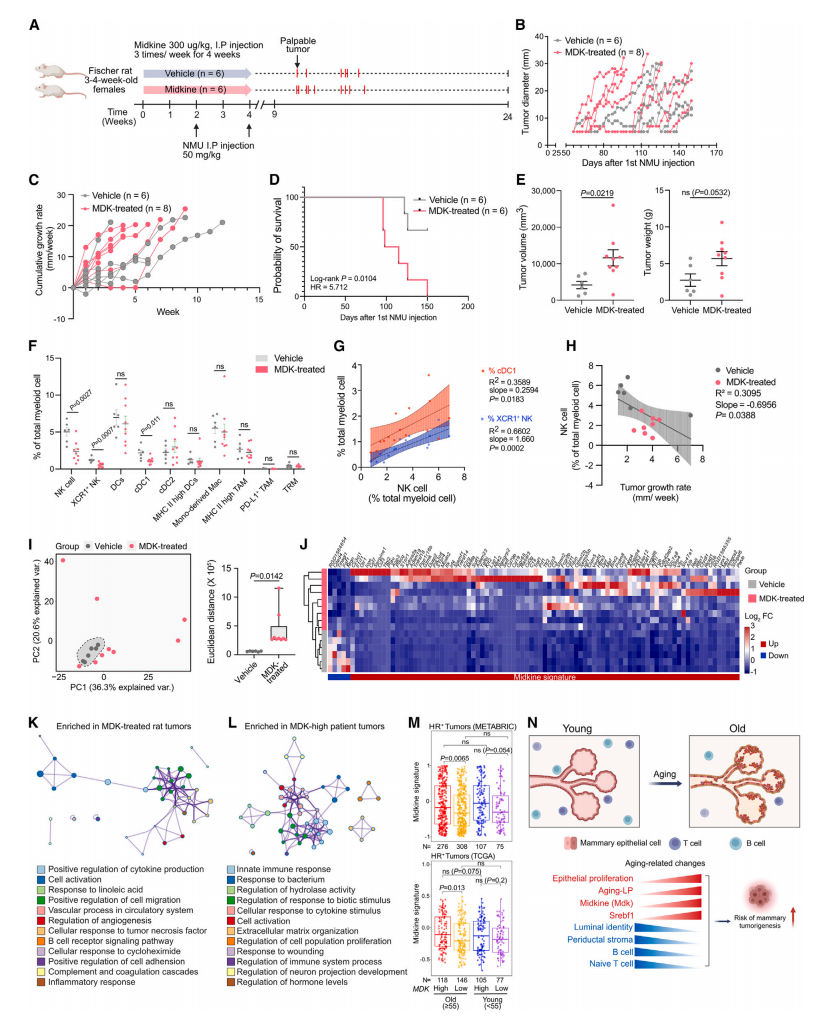
本研究通过整合单细胞转录组、染色质可及性测序等多模态组学技术,系统性绘制了乳腺衰老与肿瘤发生过程中的分子调控网络,首次构建了以Midkine为核心的衰老相关分泌表型图谱,是衰老微环境与肿瘤起源机制研究中的一项重要突破。
该研究不仅深化了对乳腺衰老过程中糖蛋白信号、免疫微环境重塑和上皮身份丢失等多层次生物学事件的理解,也凸显了多组学整合策略在解析复杂生物学过程中的关键价值。所构建的Midkine相关信号网络和衰老分子标签,为未来乳腺癌的早期风险预警、靶向预防以及个体化治疗提供了新靶点与数据支撑,也为衰老相关肿瘤起源研究提供了新的组学范式和深入探索的方向。
随着多组学技术在肿瘤微环境与衰老研究中日益深入,高通量、高精度的组学数据整合与功能解析已成为揭示疾病机制的关键环节。然而,多模态数据的整合分析、细胞异质性的解析以及关键分子通路的实验验证仍面临巨大挑战。
为此,谱研生物依托先进的单细胞转录组平台与其他多组学整合分析体系,为客户提供最专业的单细胞多组学联合分析服务与定制化功能验证解决方案。我们提供包括单细胞转录组、蛋白组、表观组在内的多维度检测与深度数据挖掘,并专注于微环境细胞互作、转录调控、代谢—信号网络整合等前沿方向的生物信息学与实验验证支持,致力于为肿瘤衰老机制研究、靶点发现及生物标志物验证提供端到端、多层次的科研技术支撑与服务闭环。
如有相关研究需求或技术合作意向,欢迎联系谱研生物团队获取详细方案与支持。
参考文献:https://www.cell.com/cancer-cell/fulltext/S1535-6108(24)00350-7?
本文由【谱研生物】原创发布,转载请标注来源。
关注公众号,回复"乳腺癌单细胞转录图谱"获取原文!
【联系我们】
谱研生物官方网站:https://www.puyanbio.com/
业务咨询:
